臓器再生医学 武部貴則准教授らの研究グループが臓器の芽を作製する革新的な培養手法を確立~腎臓や膵臓など、さまざまな器官再生へ道~
2015.04.17
- TOPICS
- 研究
臓器再生医学 武部貴則准教授らの研究グループが臓器の芽を作製する革新的な培養手法を確立~腎臓や膵臓など、さまざまな器官再生へ道~
~『Cell Stem Cell』に掲載~

横浜市立大学大学院医学研究科 臓器再生医学 武部貴則 准教授、同 谷口英樹 教授、埼玉大学大学院理工学研究科 吉川洋史 准教授らの共同研究グループは、立体的な器官原基(臓器の芽)を人為的に創出する汎用的な培養手法を確立しました。
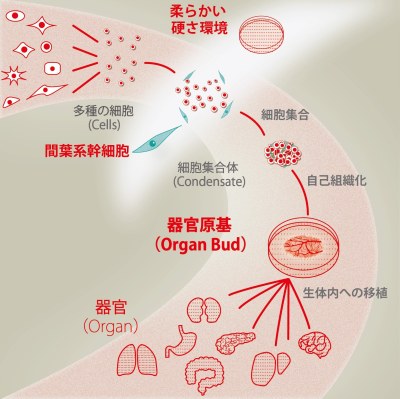
まず、同グループが2013年に報告したヒトiPS細胞から肝臓原基を形成する培養手法におけるメカニズムを詳細に解析したところ、立体的な肝臓原基の作製には、1. 間葉系細胞の存在、および 2. 培養系における物理的な外部環境(硬さ環境)の最適な条件設定、により多細胞集団が収縮現象を引き起こすこと、が必須であることを明らかにしました。
さらに、このメカニズムを他器官の作製に応用した結果、肝臓のみならず、膵臓、腎臓、腸、肺、心臓、脳から分離した細胞から3次元的な器官原基を創出することに成功しました。創出された3次元器官原基は、移植後すみやかに血流を有する血管網を再構成するのみならず、機能的な組織を自律的に形成することが明らかとなりました。本論文ではその代表事例として、尿を産生する腎組織や、糖尿病治療効果を有する膵組織を生み出すことに成功しています。本技術は、さまざまな器官の再生医療を目指す上で画期的な技術基盤となるのみならず、新たな医薬品開発のツールとしての応用が強く期待されます。
まず、同グループが2013年に報告したヒトiPS細胞から肝臓原基を形成する培養手法におけるメカニズムを詳細に解析したところ、立体的な肝臓原基の作製には、1. 間葉系細胞の存在、および 2. 培養系における物理的な外部環境(硬さ環境)の最適な条件設定、により多細胞集団が収縮現象を引き起こすこと、が必須であることを明らかにしました。
さらに、このメカニズムを他器官の作製に応用した結果、肝臓のみならず、膵臓、腎臓、腸、肺、心臓、脳から分離した細胞から3次元的な器官原基を創出することに成功しました。創出された3次元器官原基は、移植後すみやかに血流を有する血管網を再構成するのみならず、機能的な組織を自律的に形成することが明らかとなりました。本論文ではその代表事例として、尿を産生する腎組織や、糖尿病治療効果を有する膵組織を生み出すことに成功しています。本技術は、さまざまな器官の再生医療を目指す上で画期的な技術基盤となるのみならず、新たな医薬品開発のツールとしての応用が強く期待されます。
※本研究は米国科学雑誌『Cell Stem Cell』に掲載されました(米国東海岸時間4月16日正午:日本時間4月17日午前1時付オンライン)。また、本研究のイメージが5月7日号の表紙に採用されました。
(図1)研究概要
(図1)研究概要
※本研究成果は、国立研究開発法人科学技術振興機構 戦略的創造研究推進事業の一環として得られました。また、文部科学省・科研費 新学術領域研究「超高速バイオアセンブラ」(代表:武部貴則、吉川洋史)、文部科学省・科研費 基盤A(代表:谷口英樹)、再生医療実現拠点ネットワークプログラム疾患・組織別実用化研究拠点(拠点B)(代表:谷口英樹)、日本IDDMネットワーク1型糖尿病研究基金などの支援も受け、本学においては「学長裁量事業(戦略的研究推進費)」のひとつに位置付けられており、先端医科学研究センターの研究開発プロジェクトユニットが推進しています。
研究の背景
iPS細胞等の幹細胞を用いた再生医療の実現を目指す上では、目的とする機能細胞のみならず、血管や血液、間質などを含む立体的な複雑構造を再現することが必要であるという仮説が有力になりつつあります。これらを実現するために、多種多様な細胞間相互作用を実現する革新的な3次元培養系が待望されていました。
同グループは近年、器官の原基(臓器の芽:Organ Bud)が胎内で形成される過程を模倣する新規の細胞培養操作技術(器官原基法:Organ Bud Generation法)を開発し、試験管内においてヒトiPS細胞から立体的な肝臓の原基(肝芽)の自律的な複合組織化(自己組織化)を誘導できることを示しました(Takebe T, et al. Nature, 2013)。本法により、特別な条件下で未分化な3種類の細胞(内胚葉細胞、血管内皮細胞、間葉系細胞)を共培養すると、培養48時間程度で立体的な肝芽が自己組織化されます(Takebe T, et al. Nature Protocols, 2014)。一方、そのメカニズムに関しては未解明な点が多く、他器官への応用可能性は不明でした。
そこで、本研究ではこれら3種の細胞を用いた肝芽の自己組織化メカニズム解明を目指し、分子生物学的手法や、細胞動態の数理解析などを組み合わせて、Organ Bud Generation法を再現するために必須となる細胞外部、および内部環境の要件の解明を試みました。さらに、肝臓で明らかとした動作原理が他器官やがん組織の再構成に利用可能であるか検討しました。
同グループは近年、器官の原基(臓器の芽:Organ Bud)が胎内で形成される過程を模倣する新規の細胞培養操作技術(器官原基法:Organ Bud Generation法)を開発し、試験管内においてヒトiPS細胞から立体的な肝臓の原基(肝芽)の自律的な複合組織化(自己組織化)を誘導できることを示しました(Takebe T, et al. Nature, 2013)。本法により、特別な条件下で未分化な3種類の細胞(内胚葉細胞、血管内皮細胞、間葉系細胞)を共培養すると、培養48時間程度で立体的な肝芽が自己組織化されます(Takebe T, et al. Nature Protocols, 2014)。一方、そのメカニズムに関しては未解明な点が多く、他器官への応用可能性は不明でした。
そこで、本研究ではこれら3種の細胞を用いた肝芽の自己組織化メカニズム解明を目指し、分子生物学的手法や、細胞動態の数理解析などを組み合わせて、Organ Bud Generation法を再現するために必須となる細胞外部、および内部環境の要件の解明を試みました。さらに、肝臓で明らかとした動作原理が他器官やがん組織の再構成に利用可能であるか検討しました。
研究の内容
まず、Organ Bud形成過程で連続的に取得した画像データの解析を行った結果、3種類の細胞が力学的に収縮することにより立体組織形成が誘発されていることが示唆されました。実際に、この収縮現象を阻害する薬剤を培養系に添加すると、Organ Budが形成されなくなることを確認しています。そこで、このような収縮現象を引き起こすために重要な細胞の種類を特定するべく、様々な細胞種の組み合わせで共培養実験を行ったところ、間葉系幹細胞の存在が器官原基の自律的形成に必須であることを見出しました。一方、細胞の収縮現象は、細胞外部環境との接着力とのバランスによってその強度が調節されています。本研究では、その調節因子の一つである細胞が付着する培養基材の物理的特性に着目し、異なる硬さ条件下で3種類の細胞の共培養を行いました。その結果、Organ Bud形成を誘発するためには、硬さに関する最適条件が存在することが判明しました。したがって、Organ Bud Generation法を実現するためには、1. 間葉系幹細胞を共培養に用いること、および 2. 培養系の硬さ環境を至適条件に設定すること、の双方による細胞の収縮現象の誘発が必須であることが明らかになりました。収縮現象というユニークなメカニズムを活用することにより、これまで困難であった多様な細胞から複合組織が生み出されることが判明しました(図1)。
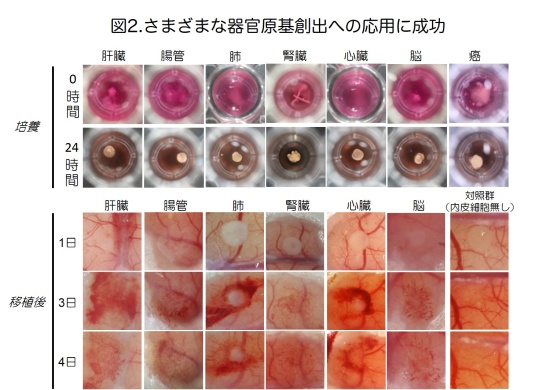
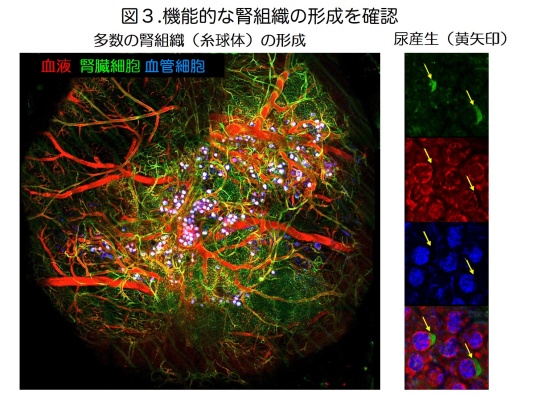
次に、間葉系幹細胞の存在とその外部環境を適切に調製した条件下において、さまざまな器官原基形成の誘発が可能であるか研究を進めました。驚くべきことに、マウス胎児等より分離した細胞を、ヒト間葉系幹細胞と共培養することで、肝臓のみならず、膵臓、腎臓、腸、肺、心臓、脳などさまざまな器官の3次元的な原基を、さらには、がん細胞から移植により血管など間質を含むヒトがん組織を再構成できる、がんの元になる組織を創出することに成功しました(図1、2)。試験管内で創出した器官原基や組織は、生体内への移植により、移植後2-3日で機能的なヒト血管網を再構成することを示しました(図2、下段)。さらに、本法を用いることにより、マウス膵β細胞株から作製した膵組織は糖尿病に対し速やかな血糖降下作用を示すこと、マウス胎児腎臓細胞より作製した腎組織は尿の産生機能を有した糸球体様構造を自律的に形成することを明らかにしました(図3)。
次に、間葉系幹細胞の存在とその外部環境を適切に調製した条件下において、さまざまな器官原基形成の誘発が可能であるか研究を進めました。驚くべきことに、マウス胎児等より分離した細胞を、ヒト間葉系幹細胞と共培養することで、肝臓のみならず、膵臓、腎臓、腸、肺、心臓、脳などさまざまな器官の3次元的な原基を、さらには、がん細胞から移植により血管など間質を含むヒトがん組織を再構成できる、がんの元になる組織を創出することに成功しました(図1、2)。試験管内で創出した器官原基や組織は、生体内への移植により、移植後2-3日で機能的なヒト血管網を再構成することを示しました(図2、下段)。さらに、本法を用いることにより、マウス膵β細胞株から作製した膵組織は糖尿病に対し速やかな血糖降下作用を示すこと、マウス胎児腎臓細胞より作製した腎組織は尿の産生機能を有した糸球体様構造を自律的に形成することを明らかにしました(図3)。
今後の展開
本研究により、Organ Bud Generation法における動作原理は、先行研究において示した肝臓のみならず、膵臓・腎臓・腸・肺などのような多様な器官を誘導する上でも有益な技術基盤であることが明らかになりました。今後、本研究で示した手法をヒトiPS細胞由来の細胞へ応用することによって、臓器不全症を対象とした器官原基移植療法(Organ bud transplantation therapy)という新たな治療概念を提唱できるものと期待されます。すなわち、糖尿病治療を目的とした膵臓再生や、腎不全症患者を対象とした腎臓再生など、さまざまな疾患治療を目指した研究開発の飛躍的な加速につながる可能性があります。また、再生医療のみならず、本手法により創出された正常・異常組織(例えば、癌など)を用いることで、新たな医薬品を開発する創薬産業への組織供給を行う上でも革新的な技術であると期待されます。
なお、本研究は、今後、国立研究開発法人日本医療研究開発機構(AMED)再生医療実現拠点ネットワークプログラムの支援を受け、横浜市立大学拠点にて、肝芽移植による臨床応用の実現を目指した技術開発を、同事業における他拠点との連携下、ヒトiPS細胞から他器官原基の創出を目指した研究開発を進めていく予定です。現時点でおそらく世界中に数万人規模で存在する、ドナー臓器を待ちながらお亡くなりになってしまう臓器不全症の患者さまを一人でも多く救済するために、ヒト臓器製造に向けた研究開発を加速します。
なお、本研究は、今後、国立研究開発法人日本医療研究開発機構(AMED)再生医療実現拠点ネットワークプログラムの支援を受け、横浜市立大学拠点にて、肝芽移植による臨床応用の実現を目指した技術開発を、同事業における他拠点との連携下、ヒトiPS細胞から他器官原基の創出を目指した研究開発を進めていく予定です。現時点でおそらく世界中に数万人規模で存在する、ドナー臓器を待ちながらお亡くなりになってしまう臓器不全症の患者さまを一人でも多く救済するために、ヒト臓器製造に向けた研究開発を加速します。
(本資料の内容に関するお問い合わせ)公立大学法人横浜市立大学 大学院医学研究科臓器再生医学武部貴則
![]() 045-787-2672 (fax:045-787-8963)
045-787-2672 (fax:045-787-8963)
(取材対応窓口、詳細の資料請求など)公立大学法人 横浜市立大学先端研究推進課長立石 建
![]() 045-787-2510 (fax:045-787-2509)
045-787-2510 (fax:045-787-2509)
国立大学法人埼玉大学大学院理工学研究科吉川 洋史
![]() 048-858-3379
048-858-3379
国立研究開発法人科学技術振興機構(JST)戦略研究推進部松尾 浩司、川口 哲、山岸 裕司
![]() 03-3512-3524 (fax:03-3222-2064)
03-3512-3524 (fax:03-3222-2064)
国立研究開発法人日本医療研究開発機構(AMED)戦略推進部 再生医療研究課宅間 裕子、伊藤 哲雄
![]() 03-6870-2220 (fax:03-6870-2242)
03-6870-2220 (fax:03-6870-2242)