脳に発生する悪性腫瘍「神経膠腫(グリオーマ)」の遺伝子変異を標的とした治療法を開発
2017.06.20
- TOPICS
- 研究
- 医療
脳に発生する悪性腫瘍「神経膠腫(グリオーマ)」の遺伝子変異を標的とした治療法を開発
米国癌学会誌『Cancer Research』に掲載
横浜市立大学 学術院医学群 脳神経外科学 立石健祐助教は、マサチューセッツ総合病院脳腫瘍研究所・ハーバード大学Daniel P. Cahill博士、脇本浩明博士、ニューヨーク大学脳腫瘍センター Andrew S. Chi博士らとの共同研究により、神経膠腫で高頻度に生じるIDH1遺伝子変異を標的とする新規治療法の開発に成功しました。
研究の背景
神経膠腫(グリオーマ)は脳または脊髄に発生する腫瘍で、人口10万人に対し1年間に12人程度発生するといわれる脳腫瘍全体の約30%を占めます 。運動麻痺、手足のしびれ、言語障害など脳の局所の機能障害や、頭痛、てんかん発作や意識障害などの症状から発症することがあります。比較的予後の良好な低悪性度神経膠腫から極めて予後不良な神経膠芽腫まで様々な病気を含めたものを神経膠腫と呼びます。
現在の悪性神経膠腫の標準的治療は、手術療法、放射線療法とアルキル化剤テモゾロミド(TMZ)による化学療法の併用療法です。TMZはDNAのO-6位グアニン残基にメチル基を付加することでDNAミスマッチによる細胞死を誘導し、抗腫瘍薬としての効果を発揮します。しかしながら、メチル基修復酵素が発現したり、ミスマッチ修復 (MMR) 遺伝子*1が変異してTMZへの耐性が生じたりすると、その効果は減弱します。また、TMZによるメチル基付加の大部分が、細胞毒性が生じないN-7位グアニン残基あるいはN-3位アデニン残基に生じてしまうことも明らかになっており、治療成績の向上に新たな治療法の開発が望まれています。
近年の大規模遺伝子解析から、低悪性度神経膠腫から続いて神経膠芽腫へと至る腫瘍の大部分で、腫瘍ができる初期段階にIDH1変異が生じることが明らかになっています。このIDH1変異は悪性度の変化、腫瘍の広がりに関わらず、腫瘍細胞内に常に認められる遺伝子異常であることから、IDH1変異を標的とする抗腫瘍薬が得られれば、多くの神経膠腫の治療法に繋がると考えられています。
発表者のこれまでの研究で、IDH1変異がNAD+*2の合成に関わる遺伝子NAPRT1のDNAメチル化を誘導すること、それによりNAPRT1蛋白の発現が抑制されて細胞内のNAD+値が相対的に低下することを見出しました。また、これに別のNAD+合成経路の律速酵素であるNAMPTの阻害剤を加えることでNAD+枯渇が生じ、これによりATPの産生が抑制され強力な細胞毒性が発揮されることを報告しました (Tateishi K et al., Cancer Cell, 2015)。しかしながら、NAMPT阻害剤は強力にNAD+合成を抑えられるものの、大量に投与すると正常細胞にまで影響してしまうことから、 NAMPT阻害剤単剤でのNAD+枯渇は臨床的には難しいとされていました。それ故にNAMPT阻害剤を減量してもNAD+を枯渇させうる治療法の開発は急務でありました。
現在の悪性神経膠腫の標準的治療は、手術療法、放射線療法とアルキル化剤テモゾロミド(TMZ)による化学療法の併用療法です。TMZはDNAのO-6位グアニン残基にメチル基を付加することでDNAミスマッチによる細胞死を誘導し、抗腫瘍薬としての効果を発揮します。しかしながら、メチル基修復酵素が発現したり、ミスマッチ修復 (MMR) 遺伝子*1が変異してTMZへの耐性が生じたりすると、その効果は減弱します。また、TMZによるメチル基付加の大部分が、細胞毒性が生じないN-7位グアニン残基あるいはN-3位アデニン残基に生じてしまうことも明らかになっており、治療成績の向上に新たな治療法の開発が望まれています。
近年の大規模遺伝子解析から、低悪性度神経膠腫から続いて神経膠芽腫へと至る腫瘍の大部分で、腫瘍ができる初期段階にIDH1変異が生じることが明らかになっています。このIDH1変異は悪性度の変化、腫瘍の広がりに関わらず、腫瘍細胞内に常に認められる遺伝子異常であることから、IDH1変異を標的とする抗腫瘍薬が得られれば、多くの神経膠腫の治療法に繋がると考えられています。
発表者のこれまでの研究で、IDH1変異がNAD+*2の合成に関わる遺伝子NAPRT1のDNAメチル化を誘導すること、それによりNAPRT1蛋白の発現が抑制されて細胞内のNAD+値が相対的に低下することを見出しました。また、これに別のNAD+合成経路の律速酵素であるNAMPTの阻害剤を加えることでNAD+枯渇が生じ、これによりATPの産生が抑制され強力な細胞毒性が発揮されることを報告しました (Tateishi K et al., Cancer Cell, 2015)。しかしながら、NAMPT阻害剤は強力にNAD+合成を抑えられるものの、大量に投与すると正常細胞にまで影響してしまうことから、 NAMPT阻害剤単剤でのNAD+枯渇は臨床的には難しいとされていました。それ故にNAMPT阻害剤を減量してもNAD+を枯渇させうる治療法の開発は急務でありました。
研究の内容
以上のことから細胞内のNAD+を枯渇させることが、抗腫瘍効果を得る上で非常に重要であることがわかったため、今回の研究ではNAD+の合成経路だけでなく、消費経路にも着目しました。中でも、NAD+を補酵素とするDNA修復遺伝子PARPを活性化すればNAD+消費の促進につながると考えました。
そこでTMZ投与によるN-7位グアニン残基あるいはN-3位アデニン残基のメチル化がPARP活性によるDNA修復で無効化されることに思い至ります。そしてTMZをIDH1変異神経膠腫幹細胞株に投与したところ、投与直後PARPの活性が急激に亢進し、同時にNAD+が消費されることが判明しました。このNAD+の消費はPARP阻害剤の投与で消失することから、PARPの活性化はNAD+消費に直接関わっていると考えられます。また、この現象は一過性で、NAD+値は経時的に回復することも明らかになりました。TMZ投与後早期の細胞毒性は認められなかったことから、PARPを介したDNA修復機構による細胞保護が生じていたと考えられます。
次にNAMPT阻害剤とTMZを併用した際の細胞毒性を検討しました。この併用療法はNAMPT阻害剤またはTMZの単剤投与の場合と比較して、より急激なNAD+値の低下が生じ、相乗効果と考えられる強力な細胞毒性を示すことが明らかになりました。一方で、IDH1野生型神経膠腫幹細胞株ではこれらの薬剤による細胞毒性は生じないので、前述の効果はIDH1変異特異的なものと考えられました。この仮説を検証するために、IDH1野生型がん細胞株にIDH1変異遺伝子を強制導入したものを用いて同様の薬剤投与を行ったところ、内因性IDH1変異細胞株での効果と類似する結果が認められました。また同じIDH1野生型がん細胞株でNAPRT1遺伝子をノックダウンした場合にも同様の結果が得られたことから、IDH1変異が誘導するNAPRT1発現抑制が薬剤の相乗効果を生んでいると推察されました。
NAMPT阻害剤とTMZの併用による細胞毒性の増強は、TMZ療法で問題になっているメチル基修復酵素の発現やミスマッチ修復 (MMR) 遺伝子の変異に影響されないことから、TMZ投与後再発時においても抗腫瘍効果が期待できると考えられます。最後に、内因性IDH1変異腫瘍細胞株を用いた動物実験で、減量したNAMPT阻害剤とTMZの併用療法でも強力に腫瘍抑制効果を発揮することを確認しました。これらの結果から、IDH1変異腫瘍細胞に対する NAMPT阻害剤とTMZの併用は、IDH1遺伝子に対する遺伝子変異特異的な腫瘍制御法であることが明らかになりました。
そこでTMZ投与によるN-7位グアニン残基あるいはN-3位アデニン残基のメチル化がPARP活性によるDNA修復で無効化されることに思い至ります。そしてTMZをIDH1変異神経膠腫幹細胞株に投与したところ、投与直後PARPの活性が急激に亢進し、同時にNAD+が消費されることが判明しました。このNAD+の消費はPARP阻害剤の投与で消失することから、PARPの活性化はNAD+消費に直接関わっていると考えられます。また、この現象は一過性で、NAD+値は経時的に回復することも明らかになりました。TMZ投与後早期の細胞毒性は認められなかったことから、PARPを介したDNA修復機構による細胞保護が生じていたと考えられます。
次にNAMPT阻害剤とTMZを併用した際の細胞毒性を検討しました。この併用療法はNAMPT阻害剤またはTMZの単剤投与の場合と比較して、より急激なNAD+値の低下が生じ、相乗効果と考えられる強力な細胞毒性を示すことが明らかになりました。一方で、IDH1野生型神経膠腫幹細胞株ではこれらの薬剤による細胞毒性は生じないので、前述の効果はIDH1変異特異的なものと考えられました。この仮説を検証するために、IDH1野生型がん細胞株にIDH1変異遺伝子を強制導入したものを用いて同様の薬剤投与を行ったところ、内因性IDH1変異細胞株での効果と類似する結果が認められました。また同じIDH1野生型がん細胞株でNAPRT1遺伝子をノックダウンした場合にも同様の結果が得られたことから、IDH1変異が誘導するNAPRT1発現抑制が薬剤の相乗効果を生んでいると推察されました。
NAMPT阻害剤とTMZの併用による細胞毒性の増強は、TMZ療法で問題になっているメチル基修復酵素の発現やミスマッチ修復 (MMR) 遺伝子の変異に影響されないことから、TMZ投与後再発時においても抗腫瘍効果が期待できると考えられます。最後に、内因性IDH1変異腫瘍細胞株を用いた動物実験で、減量したNAMPT阻害剤とTMZの併用療法でも強力に腫瘍抑制効果を発揮することを確認しました。これらの結果から、IDH1変異腫瘍細胞に対する NAMPT阻害剤とTMZの併用は、IDH1遺伝子に対する遺伝子変異特異的な腫瘍制御法であることが明らかになりました。
今後の展開
本研究結果から、NAMPT阻害剤とTMZの併用療法はIDH1変異細胞に対し選択的な細胞毒性を発揮することが見出されました。この作用には、従来のTMZとは異なる機序での細胞毒性効果も期待されるとともに、TMZ治療後再発時の治療効果も期待されます。
この併用療法は、神経膠腫の大部分を占めるIDH1変異腫瘍に対する標的治療につながることが期待されますが、一方で薬剤の脳内への移行性や生体への影響など課題は残っています。有効性と安全性を高めた治療法を確立し、薬剤の開発など臨床応用に向けた研究を進めるために、企業との連携などを推進する必要があると考えています。
図1TMZとNAMPT阻害剤併用によるIDH1変異グリオーマの細胞死メカニズム
この併用療法は、神経膠腫の大部分を占めるIDH1変異腫瘍に対する標的治療につながることが期待されますが、一方で薬剤の脳内への移行性や生体への影響など課題は残っています。有効性と安全性を高めた治療法を確立し、薬剤の開発など臨床応用に向けた研究を進めるために、企業との連携などを推進する必要があると考えています。
図1TMZとNAMPT阻害剤併用によるIDH1変異グリオーマの細胞死メカニズム
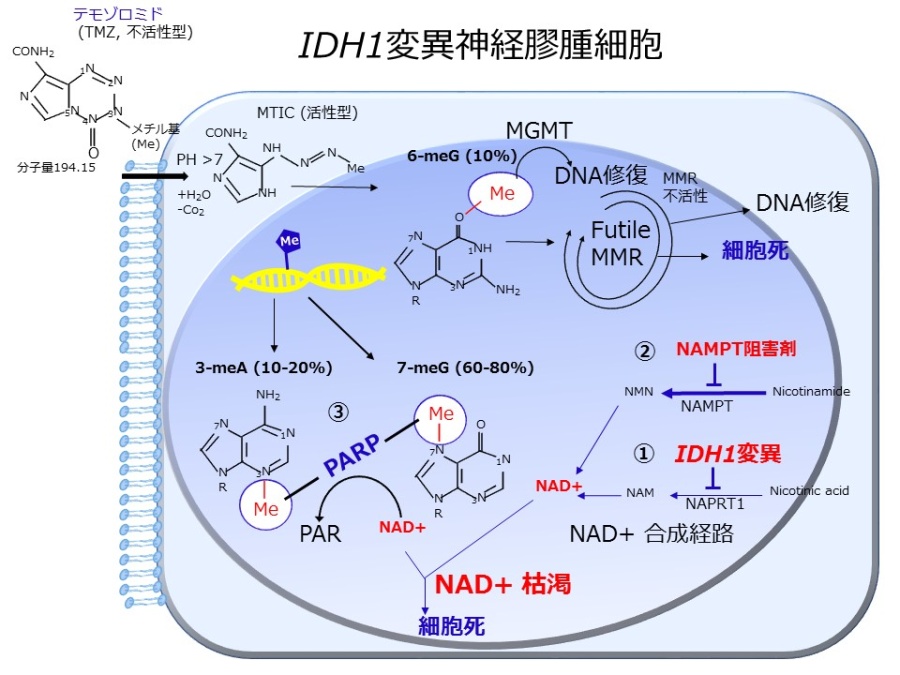 (1) IDH1変異がNAD+合成に関わる遺伝子NAPRT1のメチル化を誘導し、NAPRT1蛋白発現が抑制されNAD+値が相対的に低下(2) (1)とは別のNAD+合成経路に関わるNAMPTを阻害することでNAD+合成経路が破綻し細胞死が生じる(3) TMZによりNAD+を補酵素とするDNA修復遺伝子PARPの活性化が生じ、NAD+消費によるNAD+枯渇をさらに促進
(1) IDH1変異がNAD+合成に関わる遺伝子NAPRT1のメチル化を誘導し、NAPRT1蛋白発現が抑制されNAD+値が相対的に低下(2) (1)とは別のNAD+合成経路に関わるNAMPTを阻害することでNAD+合成経路が破綻し細胞死が生じる(3) TMZによりNAD+を補酵素とするDNA修復遺伝子PARPの活性化が生じ、NAD+消費によるNAD+枯渇をさらに促進
用語説明
*1 ミスマッチ修復 (MMR) 遺伝子:TMZによる細胞毒性に重要な役割を果たす。一方TMZ投与後MMR遺伝子の変異が生じ、その結果TMZに対し耐性を生じることが知られている。
*2 NAD+(ニコチンアミドアデニンジヌクレオチド):生体内ではNAD+は主に再合成経路により生成される。NAD+はDNAの修復や老化に関連するタンパク質の活性化、代謝経路の制御に極めて重要な役割を果たす。
*2 NAD+(ニコチンアミドアデニンジヌクレオチド):生体内ではNAD+は主に再合成経路により生成される。NAD+はDNAの修復や老化に関連するタンパク質の活性化、代謝経路の制御に極めて重要な役割を果たす。
掲載論文
“The alkylating chemotherapeutic temozolomide induces metabolic stress in IDH1-mutant cancers and potentiates NAD+ depletion-mediated cytotoxicity”
Kensuke Tateishi, Fumi Higuchi, Julie J. Miller, Mara V.A Koerner, Nina Lelic, Ganesh M. Shankar, Shota Tanaka, David E. Fisher, Tracy T. Batchelor, A John Iafrate, Hiroaki Wakimoto, Andrew S. Chi, Daniel P. Cahill
Cancer Res June 16 2017DOI:10.1158/0008-5472.CAN-16-2263
※この研究は、文部科学省 科学研究費補助金基盤研究(C)、公益財団法人安田記念医学財団 若手癌研究助成、公益財団法人横浜学術教育振興財団、横浜市立大学学長裁量事業 第1期学術的研究推進事業の一環として行われました。
Kensuke Tateishi, Fumi Higuchi, Julie J. Miller, Mara V.A Koerner, Nina Lelic, Ganesh M. Shankar, Shota Tanaka, David E. Fisher, Tracy T. Batchelor, A John Iafrate, Hiroaki Wakimoto, Andrew S. Chi, Daniel P. Cahill
Cancer Res June 16 2017DOI:10.1158/0008-5472.CAN-16-2263
※この研究は、文部科学省 科学研究費補助金基盤研究(C)、公益財団法人安田記念医学財団 若手癌研究助成、公益財団法人横浜学術教育振興財団、横浜市立大学学長裁量事業 第1期学術的研究推進事業の一環として行われました。
お問い合わせ先
(取材対応窓口、資料請求など)
横浜市立大学研究企画・産学連携推進課長渡邊誠
Tel:045-787-2510FAX:045-787-2509
E-mail:kenki@yokohama-cu.ac.jp
横浜市立大学研究企画・産学連携推進課長渡邊誠
Tel:045-787-2510FAX:045-787-2509
E-mail:kenki@yokohama-cu.ac.jp