

研究セミナー特集

マイクロ工学と材料・生物学の融合による医療応用技術 機械工学や高分子化学と生物学・医学との学際的融合による研究と成果
2018年1月11日(木)開催
会場:本学 カメリアホール
● 講演:慶應義塾大学 大学院理工学研究科 総合デザイン工学専攻:尾上弘晃准教授
● 招聘コーディネーター教授:小島伸彦准教授
尾上弘晃准教授による講演

 尾上 弘晃准教授
尾上 弘晃准教授

東京大学工学部機械情報工学科卒業を経て東京大学情報理工学系研究科知能機械情報学・博士号を取得。日本学術振興会特別研究員、カリフォルニア大学バークレー校化学科客員研究員などを経験し、現在、慶應義塾大学大学院理工学研究科、総合デザイン工学専攻・准教授として研究活動と学生の指導を行う。
2017年にはマイクロ加工技術を利用した人工生体組織構築の研究において文部科学大臣表彰・若手科学者賞を受賞する。
主たる研究分野をナノマイクロシステム、知能機械学・機械システムとすることから、機械工学と生物学、医学といった分野に幅広く精通し、その研究成果は工学分野のみならず、人工組織の開発など、近未来の医療の世界にも大きく貢献することが期待されている。
研究の原点は、「昆虫型マイクロロボ」
みなさん、はじめまして。慶応義塾大学の尾上と申します。今日はよろしくお願いします。
まず初めに、プロフィールにもあるように、なぜ私がマイクロ工学の専門として今に至るかといいますと、私が大学1〜3年ぐらいの時は宇宙とかヒューマンロボットなどに興味があったのですが、やがて「もう少し生物寄りのことを研究したい」と思うようになり、昆虫型マイクロロボという小さいロボットを作る研究室に入りました。そこで昆虫の身体の仕組みをもっと取り入れたらより上手く作れるんじゃないかというような研究に没頭するようになりました。例えば、トンボの目は複眼で、人間の目とは全く別のシステムになっています。人間の目はレンズが1個あって、レンズ1個に対してたくさんの回路を持つ工学システムです。対してトンボはレンズが非常にたくさんあって、その後ろの組織というのはすごくシンプルです。ですが、凄いスピードで飛んでいても、障害物にぶつからずに避けられるということは、この小さいビジョンシステムで、飛翔体としての画像処理がうまくできている、面白いセンサーだということがわかります。そうしたことをきっかけに、こうしたシステムを作るのにどういう処理が必要なのか? というような研究をしていました。これが私の今に至る研究の原点です。

その後、マイクロマシンを作るにはどうしたらいいかという、よりディープな研究を始めました。当時(2000年頃)は小さいマシンをそもそもどうやって作ったらいいかということ自体がわかっていませんでした。そもそもひとつの部品がとても小さく、手で掴んだり並べるたりすることができません。システムをたくさん作るのにも物凄い時間がかかってしまいます。ではどうしたらいいんだろうということで考えたのが、まず部品をたくさん用意し、それをかき混ぜてしまいます。そのうちに部品が勝手にくっついて機械ができたらいいんじゃないかと。あたかも化学反応が進むようにして機械を作るという視点で研究をはじめました。
簡単に説明すると、細胞と同じくらいの大きさのマイクロマシンをパーツに見立てた粒子として作り、その粒子をたくさん集めて、ディッシュの中にかける。かき混ぜている内に勝手に部品同士がくっついていき、そのくっつき方を制御する、というような方法です。この方法で部品を組み立てていくという、基礎的な研究です。

再生医療との出会い

こういう形で本格的に機械工学のマイクロマシンの研究を進めたのですが、このような研究をしていると、実際に生物がどのような化学反応で、物質を作るにはどうなっているのかということに非常に興味が湧いてきます。その後博士号を取ったのを皮切りに、研究対象を部品というものから細胞に変えた研究をしたいなと思い、カリフォルニア大学バークレー校に留学しました。そこでは、部品を細胞として、細胞をチップの上に並べて、そこに薬をかけたりして、アッセイをする、いわゆるアッセイチップというものの研究に取り組みました。まさに私の考えていた研究の世界がそこにあったわけです。何しろ、部品が細胞になっているため、自分で作る必要がなく、どんどん増えていくので非常に使いやすく、自分が欲しい場所に細胞を並べるという研究を、博士の後2、3年行いました。

このように細胞を並べる研究をしているとき、ちょうど日本で再生医療のプロジェクトが立ち上がりました。再生医療には見方がいろいろあると思うのですが、工学的に見ると、要は細胞を3次元的に綺麗に並べてある程度形を作って、それを正準化させて臓器をつくる、というようにも解釈できます。生物学の視点とは異なり、工学的な視点で臓器の形成というのは3次元的に並べるという風に見えるわけです。私は小さい粒子を並べるプロフェッショナルだったので、マイクロ工学の専門家として再生医療の技術開発に呼ばれ、それに取り組むということになりました。
組織工学と再生医療の挑戦
私自身、再生医療に関しての技術開発では、過去にハイドロゲルマイクロファイバーというのを開発していました。これはウィキペディアなどでも出てくる、いわば再生医療のコンセプトです。患者がいて、それから細胞を取ってきて、増やして、臓器の形に固めて戻してあげる。そうすれば、移植のドナーを待たずに自分の臓器や失われた機能、再生機能などが回復する、究極の医療の方法ではないかということで非常に注目されています。
みなさんご存知の通り、細胞のソースを準備するという点においては、山中先生がノーベル賞を受賞したiPSによって技術が蓄えられています。もうひとつ、この準備した細胞を固めて臓器として機能がある形にして戻す。この部分というのが細胞ソースを準備するのと同じくらい大切だということは皆さんも聞いたことがあると思います。いろいろな研究者が工夫をしていると思うのですが、ここに関して私のような工学的なアプローチが有効ではないかということで、最近は工学者と生物学者の融合による研究が進んでいるというのが現状なのではないかと思います。
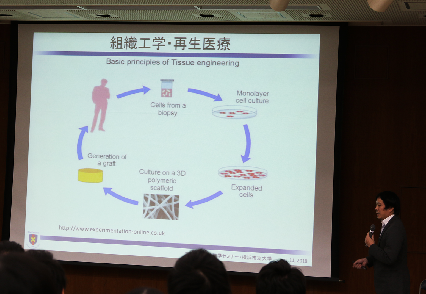
この3次元的に臓器を作るということは実は昔からやられているもので、例えば1993年にサイエンスによってネズミの身体に耳の形のようなものを作ったという非常にセンセーショナルな形で報告されて話題になったことをご存知かと思いますが、これより少し前からこういうような研究は進んでいました。どのようなアプローチかというと、スキャフォールドといわれる生体適合性があるポリマーの上に細胞を置きます。そうするとそのポリマーの形に細胞が培養できて、願わくば色々な臓器のような3次元的な形状を持った組織ができたら、というアプローチです。このアプローチは非常に有効で、既にいろいろな臨床現場で使われていて、例えば肌、軟骨、骨、膀胱などの組織についてはかなりの研究が進んで実用が近づいています。重要なのは心臓、肝臓、膵臓など、臓器不全になって非常に多くの患者さんが苦しんでいると思うのですが、こういった複雑な形状の臓器をなんとか作りたいというのが今の組織工学の願いであり、目標のひとつです。

これはなかなか難しく、肝臓を例にすると、3次元的に色々な細胞が配置されていて、血管ができていて、単純にポリマーの上に細胞を撒いたというだけではとても作れない構造です。それでもなんとか作りたい。ではどういう風に作ろうかという形で色々なアプローチがあるのですが、先ほど言いましたポリマーとを有効に使うアプローチと言った方法があります。今は工学的に、逆に色々な細胞のモジュールを使って、それを何とかして組み立てて、複雑な3次元構造を作ろうというボトムアップのアプローチというのが非常に多く研究されています。例えばセルシート。細胞のシート状にして積み重ねているというような技術です。それが最近は3Dプリンタの技術に非常にマッチし、実際に細胞をプリンターで打ち出して3次元構造ができればこういった複雑な機能ができるんじゃないかということで現在、盛んに技術開発が進んでいます。
“紐状ユニット”への着目
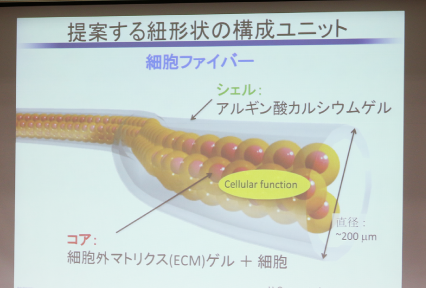
こういう現状の中で私は、紐状のユニットが実は有効なんじゃないかと考えたわけです。どうしてそこに着目したかというと、大雑把な話で申し訳ないのですが、細長い組織というのは人体にはたくさんありまして、しかもこれは非常に大切なものばかりで基礎となる構造な訳です。神経、筋肉などもそうです。また、繊維というか管、血管ですね。これは本当に体内に栄養循環するためにとても重要です。心臓を中心として、生命を維持するための器官があります。ですから、もしこういう紐状の組織というのを簡単に作ることができれば、組織工学においてとても有効なツールになるんじゃないかという発想で研究を開始しました。どうやって紐状にするかという話ですが、アイデアは本当に簡単で、アルギン酸カルシウムゲルと言う、人工イクラに使われているもので(例えれば白滝のようなゼリーです)、そのチューブの中に細胞を封入します。細胞を入れるだけでは増えないので細胞の周りに細胞外マトリックス、例えばコラーゲンを人間の体の中でも細胞と細胞の間を埋めている物質を入れておきます。直径が大体200マイクロメートルなので髪の毛の太さより少し太いくらいです。それを培養すると、チューブの中で細胞を培養しているので、中に細胞が満ちてきて、細長い組織ができるだろうと。アイデアとしては簡単ですね。そうすれば筋肉、神経、血管のような構造がこのような形で作れるんじゃないかという期待を込めて研究を始めました。

さて、問題はどうやって実際に作るのかというところです。そこに私の専門分野のマイクロ工学という知識が非常に有効になったのです。流体の分野の話なのですが、例えばタバコを吸うと煙がすっと流れ、乱れる現象はみなさん感覚的にわかると思うのですが、これは乱流と言いまして、レイノルズ数という物理量がおおよそ2000以上と規定されている時にこのような流体の振る舞いをします。ところがこのような流れは、小さいスケールで非常に粘性が高い、また流速が低い状態ですと流れの様子が変わってきます。例えば直径1mm弱くらいの流路の中に水を流すとカーブがあっても混ざらずに流れる、層流という現象が起きてきます。小さいスケールだとこのような層流が起きるということが知られていて、このような現象をうまく使って、先ほどのゲルのチューブというものを作ります。そして簡単にいいますと、ここにアルギン酸という先ほどのゲルが固まる前の液を流します。このゲルというのはカルシウムイオンと反応するとゲル化するという性質があります。このような構成で層流を作ってあげますと、流れ自体は乱されないのですが、カルシウムのイオンがアルギン酸の流れの中に拡散していって、流れながらゾルだったものがゲルになるということが起きます。ここで細長いゲルの紐ができる、これが作り方の原理です。
これは実際に見るとわかるのですが、ガラス管のチューブ、3Dプリンタのコネクタを使ってこのような構成の流路を作ります。どうやるのかといいますと、まず一番内側の流れに細胞とコラーゲンを入れておいて、その次の外側の流れにチューブの外側となる液のアルギン酸を入れておく。層流ができたところで最後に外側から塩化カルシウムの液を流す。そうすると流れている間に外側が固まって、チューブが断続的に生成されるというシステムです。細かい条件はともかく、流れとしては同軸の流れですね。実際に作っているところの映像も見ながらご説明しますが、これはアルギン酸という外側のシェルの部分に色をつけたものなのですが、流すと綺麗に管の中を流れます。これは大体管の内径が0.6mmぐらいです。外側から見えていると思うのですが、管はここにあって、このような形でどんどんゲルの紐がチューブの中に連続的にできていきます。作られたゲルの紐は意外と機械的に安定しておりまして、例えばチューブを外してあげても綺麗に、割としっかりとした細いゲルの紐をこういうようなガラス管をうまく繋げることで作ることができます。これは先ほどは見やすいように色をつけていたのですが、この映像は実際に細胞を入れているものです。細胞が高濃度で入っているので白く見えているのですが、どんどん紐を押し出すようにして、細胞をパッケージとしたようなユニット、我々はこれを「細胞の紐」といっているのですが、そういうものを作ることができます。この紐なのですが、この外側のゲルがちょうど栄養を通しますので、いわゆる細胞培養ディッシュの上にポチャンと入れて培養することができるわけです。白髪のようなものが浮いて見えますが、顕微鏡で見るとこうしたゲルの中に細胞が封入されているという構成になっています。こうして、紐状の組織を工学的な手法と生物学・医学的な考えの融合によって作ることが可能になってきました。






